品質への取り組み
T’sの品質

私たちT’s(ティーズ)は、患者さんの健やかな暮らしを支える医薬品をお届けすることを使命とし、次の品質方針のもと、たゆまぬ努力を重ねています。
【T’sの品質方針】
品質はT’sの最優先事項です。
T’sファーマ株式会社/T’s製薬株式会社(以下、「T’s」という)は、患者さんへ安全で高品質な医薬品を提供するため「品質方針」を以下に定めます。
私たちは、製造販売承認書に定められた規格に適合する医薬品を提供します。
私たちは、製造販売承認に関わる薬機法、GQP省令、GMP省令、その他GxP省令や適切な法令及びガイドラインに準拠して生産される医薬品を提供します。
私たちは、意図した使用目的に見合った医薬品を提供します。
私たちは、患者さんの安全性、製品品質、有効性を担保するだけでなく、製品及び医薬品品質システム(PQS)の継続的改善に努力します。
私たちは、自身の業務を正確かつ適切に遂行するために、業務手順の習熟や最新のGMPに関する定期的な研修を行います。
私たちは、日常業務の質に対する社員一人ひとりの意識を向上することにより、品質を包括的に担保するカルチャーを醸成します。
取り扱う全ての製品に対し厳格な品質基準を適用しています。T’sの品質基準は、ICH*1ガイドライン、最新のPIC/S*2の要求事項を組み入れており、日本を含む各国の規制基準を十分に満たす業界最先端の基準です。当社で製造販売する医薬品はこの厳しい基準を満たしていなければ、決して市場に出荷されません。
当社の基準に合致した国内外の有数の工場と関連部門が連携して世界に誇ることができる品質を追求しています。そして、確かな品質な製品の提供を通じて皆様の健康に貢献します。
信頼性の確保に向けて

当社の医薬品へのさらなる信頼性の確保に向けて、当社製品を製造する国内外の製剤製造所を対象に製造販売承認書と実際の製造方法・手順や規格・試験方法との齟齬がないかを確認しています。
調査体制
T’sファーマ株式会社(2021~25年の調査時点の社名は、武田テバファーマ株式会社)およびT’s製薬株式会社(同時点の社名は、武田テバ薬品株式会社)の2社それぞれの総括製造販売責任者のもと、薬事や品質保証(GQP)といった関連部門で構成するプロジェクトチーム
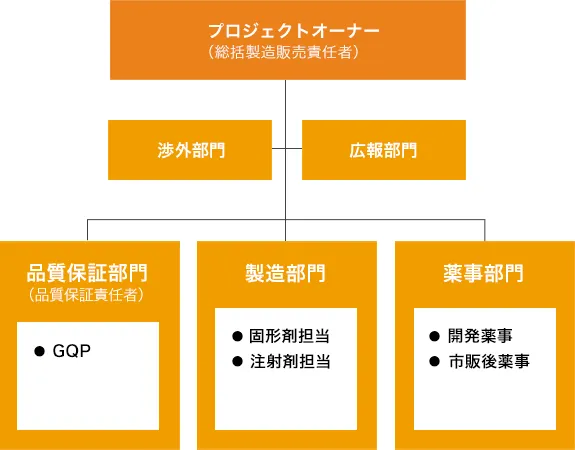
製造販売承認書チェックの概要
2021年3月より「製造販売承認書チェック」を行いました。当社製品を製造する国内外の製剤製造所を対象に製造販売承認書と実際の製造方法・手順との齟齬がないかを自主的に確認しました。
調査対象
武田テバファーマ株式会社および武田テバ薬品株式会社(実施当時の社名)が製造販売承認を有する、オーソライズド・ジェネリック(AG)を含むジェネリック医薬品*1と長期収載品の製造を委託する国内・海外全ての製剤製造所
*1 2021年2月に日医工株式会社に資産譲渡した製品、また経過措置の製品は除く
調査状況
2021年 製造方法・手順
3月より製造販売承認書と実際の製造方法・手順との整合性を点検する「製造販売承認書チェック」*2を開始し、12月末をもってジェネリック医薬品71品目および長期収載品86品目の調査を予定通りに完了しました。
*2 日本ジェネリック製薬協会の通知「ジェネリック医薬品の信頼性確保に関する対応について」(令和3年3月25日GE薬協会発第25号)に基づいて実施。
〈製造販売元別の調査結果〉
| カテゴリー | 点検品目数 | 薬事対応が必要と判断した品目数 | 当局相談等により薬事対応が確定している品目数 | 今後当局相談を実施する予定の品目数 | ||
|---|---|---|---|---|---|---|
| 一変申請 | 軽微変更届 | |||||
| 武田テバファーマ 株式会社 |
ジェネリック医薬品 | 64 | 0 | 0 | 0 | 0 |
| 武田テバ薬品 株式会社 |
ジェネリック医薬品 | 7 | 0 | 0 | 0 | 0 |
| 長期収載品 | 86 | 0 | 0 | 0 | 0 | |
2022年 規格及び試験方法
1月より自主的に製造販売承認書と実際の規格及び試験方法との整合性を点検する「製造販売承認書チェック」の準備を開始し、12月末をもってジェネリック医薬品66品目および長期収載品82品目の調査を完了しました。
〈製造販売元別の調査結果〉
| 社名 | 種別 | 点検対象品目数 | 着手品目数 | 完了品目数 |
|---|---|---|---|---|
| 武田テバファーマ 株式会社 |
ジェネリック医薬品 | 65 | 65 | 65 |
| 武田テバ薬品 株式会社 |
ジェネリック医薬品 | 1 | 1 | 1 |
| 長期収載品 | 82 | 82 | 82 |
厚生労働省の通知に基づく自主点検調査の概要
2024年 製造方法及び試験方法
「後発医薬品の製造販売承認書と製造方法及び試験方法の実態の整合性に係る点検の実施について」(令和6 年4 月5 日 医政産情企発0405第1号 医薬薬審発0405第8号 医薬監麻発0405第1号)に基づき、4~10月に自主点検を実施しました。
点検内容
製造販売承認書に記載の次の欄について、承認書と製造の実態との整合性
「製造方法欄」
「規格及び試験方法欄」及び「別紙規格欄」
武田テバが製造販売承認を取得しているジェネリック医薬品74品目について、管轄の愛知県、大阪府に点検結果を報告いたしました。品質、安全性等に影響を与える結果はございませんでした。
なお、当社では長期収載品*3についても、ジェネリック医薬品と同様に点検を実施しました。
*3 販売中止品は点検対象外
〈製造販売元別の調査結果〉
| 社名 | 種別 | 対象品目数 | 点検指示 | 製造所における 点検終了数 |
武田テバでの 評価完了数 |
|---|---|---|---|---|---|
| 武田テバファーマ 株式会社 |
ジェネリック 医薬品 |
73 | 73 | 73 | 73 |
| 武田テバ薬品 株式会社 |
ジェネリック 医薬品 |
1 | 1 | 1 | 1 |
| 長期収載品 | 71 | 71 | 71 | 71 |
【都道府県への調査結果報告状況】
武田テバファーマのジェネリック医薬品:2024年10月31日付で愛知県への報告を完了
武田テバ薬品のジェネリック医薬品: 2024年8月9日付で大阪府への報告を完了